Reactivo en Exceso: Todo lo que necesitas saber sobre este concepto crucial para reacciones químicas
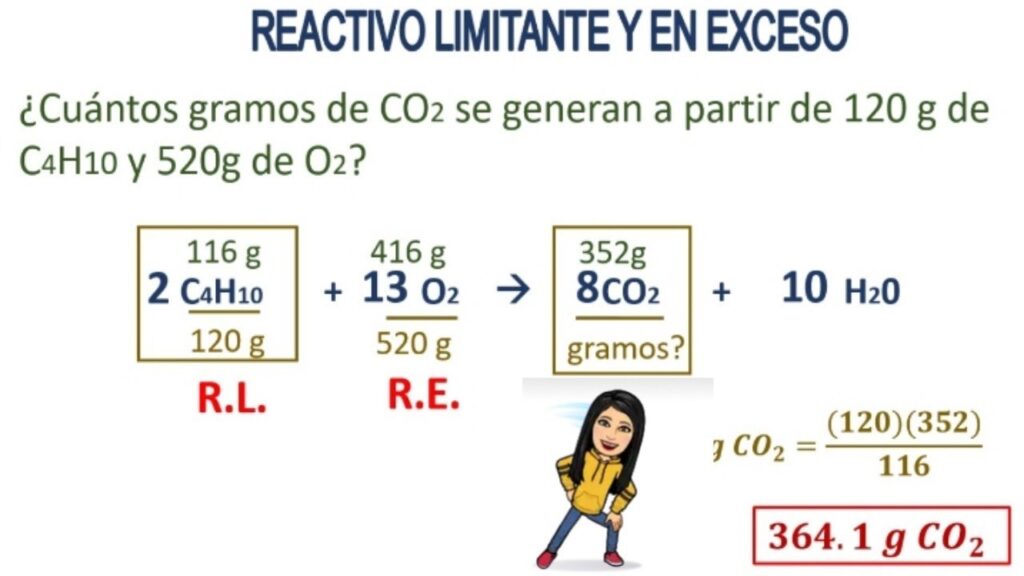
En química, una reacción puede ocurrir cuando dos sustancias se combinan en proporciones estequiométricas, es decir, en la cantidad exacta para que se consuma completamente una sustancia y se produzca un subproducto. Sin embargo, en muchas ocasiones se utiliza un reactivo en exceso, lo cual tiene implicaciones clave en la velocidad de la reacción y en el rendimiento del producto final.
Exploraremos qué significa exactamente el concepto de "reactivo en exceso" y cómo afecta una reacción química. Analizaremos los efectos de utilizar un reactivo en exceso y las razones por las cuales podría ser deseable o no. También discutiremos ejemplos específicos de reacciones con reactivo en exceso y cómo se pueden calcular las cantidades necesarias para lograr una reacción eficiente y optimizar el proceso químico. ¡Sigue leyendo para conocer más sobre este importante tema en química!
- Qué es un reactivo en exceso y cómo afecta las reacciones químicas
- Cuáles son los posibles peligros de utilizar un reactivo en exceso en un experimento
- Cuáles son los beneficios de controlar correctamente el reactivo en exceso en una reacción química
- Cómo se determina la cantidad adecuada de reactivo en una reacción química
- Qué sucede si no se controla el reactivo en exceso en una reacción química
- Cuál es la relación entre el reactivo limitante y el reactivo en exceso en una reacción química
- Existen formas de evitar el uso incorrecto de un reactivo en exceso en el laboratorio
- Cómo se puede calcular la cantidad de reactivo en exceso en una reacción química
- Qué precauciones deben tomar los científicos al utilizar un reactivo en exceso en una reacción específica
- Cuáles son algunos ejemplos comunes de reacciones químicas en las que se utiliza un reactivo en exceso
- Preguntas frecuentes (FAQ)
Qué es un reactivo en exceso y cómo afecta las reacciones químicas
Un reactivo en exceso es aquel reactante que se añade en mayor cantidad a una reacción química de lo que se requiere teóricamente para que ocurra la reacción completa. En otras palabras, es cuando hay una sobredosis de uno de los componentes en una reacción química.
La presencia de un reactivo en exceso puede tener varias implicaciones en una reacción química. Por un lado, si el reactivo en exceso es una sustancia cara o difícil de obtener, esto puede resultar en una pérdida económica o de recursos. Por otro lado, si el reactivo en exceso es un compuesto reactivo, esta condición puede tener consecuencias negativas en la eficiencia de la reacción o incluso en la calidad del producto obtenido.
Efectos de un reactivo en exceso
Uno de los efectos más comunes de un reactivo en exceso es la formación de subproductos no deseados. Esto ocurre cuando el reactivo en exceso reacciona con otros compuestos presentes en la mezcla, generando productos secundarios indeseados. Estos subproductos pueden afectar tanto la pureza como la composición química del producto final.
Otro efecto importante tiene que ver con la velocidad de la reacción. El uso de un reactivo en exceso puede acelerar o retardar la velocidad de la reacción, dependiendo de las propiedades de los reactivos involucrados. En algunos casos, el exceso de reactante puede aumentar la velocidad de reacción al proporcionar más colisiones efectivas entre las moléculas. Sin embargo, en otros casos, la presencia de un reactivo en exceso puede disminuir la velocidad al desplazar el equilibrio hacia atrás, inhibiendo la formación de productos.
Además, un reactivo en exceso puede afectar también el rendimiento de una reacción química. Si uno de los reactivos es limitante y se agota antes de que el exceso de reactivo tenga oportunidad de reaccionar completamente, se produce un rendimiento menor al esperado. Esto significa que no se obtendrá la cantidad máxima posible de producto deseado.
Cómo controlar el reactivo en exceso
Para evitar o controlar los efectos negativos del reactivo en exceso, es imprescindible conocer bien las estequiometrías y proporciones adecuadas de los reactivos involucrados en una reacción química. Esto implica realizar cálculos precisos para determinar la cantidad necesaria de cada reactivo y asegurar que ninguno de ellos esté en exceso.
Una forma de controlar el reactivo en exceso es utilizar reactivos puros y de alta calidad, evitando impurezas que puedan generar reacciones secundarias no deseadas. Asimismo, es importante llevar a cabo cuidadosamente las mediciones y dosificaciones de cada reactivo para evitar errores en la preparación de la solución.
En algunos casos, si se sospecha que hay un exceso de reactivo, se puede agregar un reactivo limitante adicional para asegurarse de que todo el reactivo en exceso reaccione por completo antes de detener la reacción.
El concepto de reactivo en exceso es crucial para comprender y controlar las reacciones químicas. La presencia de un reactivo en exceso puede tener diversos efectos tanto en la pureza como en la velocidad y rendimiento de la reacción. Por ello, es fundamental realizar los cálculos estequiométricos adecuados y llevar a cabo un control riguroso de los reactivos utilizados.
Cuáles son los posibles peligros de utilizar un reactivo en exceso en un experimento
El uso de un reactivo en exceso en una reacción química puede tener varios peligros potenciales que deben tenerse en cuenta al diseñar y llevar a cabo experimentos. Cuando se añade un reactivo en cantidad excesiva, se pueden producir reacciones descontroladas e indeseables, lo que puede comprometer tanto la seguridad del experimentador como los resultados obtenidos.
Uno de los principales peligros de utilizar un reactivo en exceso es la posibilidad de generar productos no deseados. En muchas reacciones químicas, los reactivos están diseñados para interactuar entre sí en proporciones estequiométricas específicas para obtener un producto deseado. Sin embargo, si se añade un exceso de uno de los reactivos, se pueden formar subproductos o productos secundarios indeseables que pueden afectar negativamente el resultado final del experimento.
Otro peligro asociado con el uso de un reactivo en exceso es el aumento del riesgo de reacciones descontroladas y explosivas. Al añadir una cantidad excesiva de reactivo, se puede generar una acumulación de energía potencial en el sistema, lo que aumenta la probabilidad de que se produzcan reacciones violentas e incluso explosiones. Este riesgo es especialmente relevante en experimentos que involucran sustancias inflamables o reactivas.
Además de los peligros mencionados anteriormente, el uso de un reactivo en exceso también puede tener implicaciones económicas y medioambientales. Utilizar una cantidad mayor de reactivo del necesario implica un desperdicio innecesario de recursos y puede ser costoso en términos de adquisición y manejo de productos químicos. Además, los residuos generados por la reacción pueden ser más difíciles y costosos de tratar y desechar correctamente.
Utilizar un reactivo en exceso en un experimento puede acarrear diversos peligros y problemas que deben tenerse en cuenta. Es esencial seguir las proporciones estequiométricas adecuadas para garantizar resultados confiables y seguros, así como minimizar el desperdicio de recursos y los impactos ambientales negativos.
Cuáles son los beneficios de controlar correctamente el reactivo en exceso en una reacción química
El reactivo en exceso es un concepto crucial en las reacciones químicas y su control adecuado puede tener varios beneficios. En este artículo, exploraremos en detalle qué significa el reactivo en exceso y por qué es importante en el contexto de las reacciones químicas.
¿Qué es el reactivo en exceso?
El reactivo en exceso es aquel que se añade en una cantidad mayor a la necesaria para llevar a cabo una reacción química. En otras palabras, es la sustancia que aún queda sin reaccionar una vez que todos los reactivos han completado su reacción. Esta situación puede ocurrir cuando existe una proporción incorrecta entre los reactivos utilizados, dando lugar a un exceso de uno de ellos.
Es importante destacar que el reactivo en exceso no siempre es perjudicial para una reacción química. De hecho, en algunos casos puede ser deseable y tiene ciertos beneficios asociados.
Beneficios de controlar correctamente el reactivo en exceso
- Mayor rendimiento de la reacción: Uno de los principales beneficios de controlar el reactivo en exceso es que puede aumentar el rendimiento de la reacción química. Al proporcionar más cantidad del reactivo limitante, se garantiza que este reaccione por completo, lo que resulta en una mayor cantidad de producto obtenido al final del proceso.
- Reducción de impurezas: Otra ventaja de utilizar el reactivo en exceso es que puede ayudar a reducir la presencia de impurezas en el producto final. Al tener un exceso del reactivo limitante, se asegura que no queden residuos sin reaccionar que puedan dar lugar a contaminantes no deseados.
- Compensación de pérdidas: Durante una reacción química, es común que ocurran pérdidas debido a diversos factores como evaporación, adsorción o reacciones secundarias. El uso de reactivo en exceso puede ayudar a compensar estas pérdidas, asegurando que aún haya suficiente reactivo para llevar a cabo la reacción completa.
- Mecanismo de control: El reactivo en exceso también puede funcionar como un mecanismo de control en ciertas reacciones químicas. En algunos casos, se utiliza un reactivo en exceso para limitar la velocidad de reacción y evitar una reacción demasiado rápida o violenta. De esta manera, se puede tener un mejor control sobre el proceso químico y evitar posibles peligros.
Controlar adecuadamente el reactivo en exceso en una reacción química tiene varios beneficios, como aumentar el rendimiento de la reacción, reducir impurezas, compensar pérdidas y actuar como mecanismo de control. Es importante tener en cuenta las proporciones y las condiciones específicas de cada reacción para determinar la cantidad adecuada de reactivo en exceso a utilizar.
Cómo se determina la cantidad adecuada de reactivo en una reacción química
La cantidad adecuada de reactivo necesario para llevar a cabo una reacción química es un aspecto fundamental a tener en cuenta. El reactivo en exceso se refiere a la cantidad de sustancia que se añade en mayor proporción de lo requerido teóricamente para completar la reacción. En este sentido, es importante comprender cómo se determina esta cantidad y cuáles son las implicaciones que puede tener en el proceso químico.
Para determinar la cantidad adecuada de reactivo en una reacción química, es necesario conocer la estequiometría de la misma. La estequiometría es la relación cuantitativa entre los diferentes reactivos y productos involucrados en la reacción. Esta información se obtiene a partir de la ecuación química balanceada que representa la reacción.
Una vez obtenida la ecuación química balanceada, se pueden utilizar cálculos estequiométricos para determinar la cantidad teórica de reactivo necesaria para completar la reacción en base a la relación de proporcionalidad establecida por la estequiometría. Sin embargo, en la práctica, es común que se utilice un reactivo en exceso por diversas razones.
Una de las razones principales para utilizar un reactivo en exceso es asegurar que la reacción química se complete en su totalidad. Esto es especialmente importante cuando existe un reactivo limitante, es decir, aquel que se consume por completo antes que los demás reactivos. Utilizar un reactivo en exceso garantiza que no se desperdicie tiempo ni reactivos en una reacción incompleta.
Por otro lado, el reactivo en exceso también puede utilizarse para favorecer el rendimiento de una reacción química. Si uno de los productos de la reacción es más valioso o útil que los demás, se puede utilizar un reactivo en exceso para aumentar la cantidad de producto deseado.
Es importante mencionar que el uso de un reactivo en exceso también puede tener implicaciones negativas. por ejemplo, puede generar residuos innecesarios o incrementar los costos del proceso. Por esta razón, es necesario encontrar un equilibrio entre la cantidad de reactivo en exceso y la necesaria para completar la reacción en una forma eficiente y rentable.
La determinación de la cantidad adecuada de reactivo en una reacción química es crucial para garantizar que la reacción se complete con éxito y de manera eficiente. Utilizar un reactivo en exceso puede ser beneficioso en algunos casos, pero también puede tener repercusiones negativas. Por ello, es importante considerar cuidadosamente la estequiometría de la reacción y evaluar las necesidades específicas antes de decidir la cantidad de reactivo a utilizar.
Qué sucede si no se controla el reactivo en exceso en una reacción química
Cuando hablamos de reacciones químicas, uno de los conceptos más importantes que debemos tener en cuenta es el reactivo en exceso. Pero, ¿qué significa realmente esto y qué sucede si no se controla adecuadamente?
Para comprender mejor este concepto, primero debemos entender que toda reacción química implica la combinación de diferentes sustancias conocidas como reactivos. Estos reactivos se combinan en proporciones específicas para producir productos químicos resultantes. Sin embargo, en ocasiones podemos utilizar una cantidad mayor de reactivo de la necesaria para asegurarnos de que la reacción se lleve a cabo por completo.
Cuando se utiliza un reactivo en exceso, significa que se ha añadido más cantidad de dicho reactivo de lo requerido según la estequiometría de la reacción. La estequiometría es la relación cuantitativa entre los reactivos y productos en una reacción química.
Uno de los principales problemas que puede surgir al usar un reactivo en exceso es que puede permanecer sin reaccionar una vez finalizada la reacción. Esto significa que parte del reactivo original se desperdicia, lo cual no solo puede ser costoso desde el punto de vista económico, sino también perjudicial para el medio ambiente.
Además, el uso de reactivo en exceso puede afectar la pureza de los productos obtenidos. Si no se controla adecuadamente, pueden formarse subproductos indeseables o impurezas en la mezcla, lo cual puede afectar negativamente las propiedades del producto final.
Por otro lado, el reactivo en exceso también puede causar problemas de seguridad. Al utilizar una mayor cantidad de reactivo, se pueden generar reacciones exotérmicas más intensas, lo que puede resultar en un aumento de la liberación de energía y, por ende, en un mayor riesgo de explosión o de generación de productos tóxicos.
Es importante destacar que el control del reactivo en exceso es esencial para garantizar la eficiencia y seguridad de las reacciones químicas. Para ello, es necesario calcular cuidadosamente las proporciones estequiométricas de los reactivos, teniendo en cuenta los coeficientes estequiométricos de la ecuación química balanceada.
El uso adecuado del reactivo en una reacción química es fundamental para asegurar resultados óptimos, tanto desde el punto de vista económico como ambiental y de seguridad. El control del reactivo en exceso nos permite minimizar desperdicios, obtener productos puros y prevenir riesgos innecesarios.
Cuál es la relación entre el reactivo limitante y el reactivo en exceso en una reacción química
En una reacción química, es común hablar de dos conceptos fundamentales: el reactivo limitante y el reactivo en exceso. Estos términos se refieren a la proporción en la cual se encuentran los reactivos involucrados en la reacción y juegan un papel crucial para determinar la cantidad de producto obtenido.
Reactivo Limitante
El reactivo limitante, también conocido como reactivo limitado o reactivo estequiométrico, es aquel que se consume por completo durante la reacción. En otras palabras, es el reactivo que está presente en menor cantidad en relación a los coeficientes estequiométricos de la ecuación química balanceada.
Para entender mejor este concepto, vamos a ver un ejemplo sencillo. Supongamos que estamos llevando a cabo la reacción entre bicarbonato de sodio (NaHCO3) y ácido clorhídrico (HCl) para producir dióxido de carbono (CO2), agua (H2O) y cloruro de sodio (NaCl). La ecuación balanceada sería la siguiente:
NaHCO3 + HCl → CO2 + H2O + NaCl
Si tenemos 4 moles de NaHCO3 y 2 moles de HCl, es evidente que no podemos consumir completamente los 2 moles de HCl debido a que no hay suficiente NaHCO3 para reaccionar con ellos según la estequiometría de la ecuación. Por lo tanto, en este caso, el reactivo limitante sería el NaHCO3.
Es importante destacar que el reactivo limitante determinará la cantidad máxima de producto que se puede obtener en una reacción química. En nuestro ejemplo, si 4 moles de NaHCO3 solo pueden reaccionar completamente con 2 moles de HCl, no será posible obtener más de 2 moles de producto.
Reactivo en Exceso
El reactivo en exceso es aquel que queda presente al finalizar la reacción, es decir, es el reactivo que ha quedado sin reaccionar debido a que había una cantidad mayor que la necesaria para reaccionar completamente con el reactivo limitante.
Tomando nuevamente el ejemplo anterior, si tenemos 4 moles de NaHCO3 y 2 moles de HCl, ya sabemos que el NaHCO3 es el reactivo limitante. Por lo tanto, el HCl se consideraría el reactivo en exceso, ya que una vez que todo el NaHCO3 haya reaccionado, aún quedará HCl sin consumir.
La presencia de un reactivo en exceso no afecta la cantidad máxima de producto que se puede obtener, ya que solo el reactivo limitante determina dicha cantidad. Sin embargo, es importante tener en cuenta que el reactivo en exceso puede generar residuos o afectar las propiedades del producto final si se encuentra en una cantidad significativa.
Entender la relación entre el reactivo limitante y el reactivo en exceso es crucial para comprender cómo funciona una reacción química. El reactivo limitante determina la cantidad máxima de producto obtenido, mientras que el reactivo en exceso queda sin reaccionar al finalizar la reacción. Ambos conceptos son fundamentales para calcular los rendimientos y las proporciones estequiométricas en un proceso químico.
Existen formas de evitar el uso incorrecto de un reactivo en exceso en el laboratorio
El reactivo en exceso es un concepto crucial en las reacciones químicas que se llevan a cabo en el laboratorio. El uso incorrecto de un reactivo en exceso puede tener consecuencias negativas en el resultado de la reacción y en la eficiencia general del proceso.
Cuando un reactivo se encuentra en exceso, significa que se ha agregado una cantidad mayor de la necesaria en la reacción. Esto puede ocurrir debido a diversos factores, como errores en las mediciones, falta de conocimiento sobre la estequiometría de la reacción o simplemente un mal cálculo.
Uno de los problemas más comunes asociados con el uso incorrecto de un reactivo en exceso es la pérdida de reactivos y la generación de desechos innecesarios. Además, también puede llevar a la formación de subproductos no deseados que pueden afectar la pureza y la calidad del producto final.
Para evitar el uso incorrecto de un reactivo en exceso, es importante seguir algunas pautas básicas durante el proceso de preparación y ejecución de la reacción. En primer lugar, es fundamental comprender la estequiometría de la reacción, es decir, la relación cuantitativa entre los reactivos y los productos. Conocer esta relación nos permitirá determinar la cantidad exacta de cada reactivo que se necesita para lograr la reacción deseada.
Además, es recomendable llevar a cabo pruebas de ensayo previas para determinar la cantidad óptima de reactivo a utilizar. Estas pruebas nos ayudarán a identificar cuál es la cantidad adecuada para lograr la máxima eficiencia de la reacción sin desperdiciar reactivos.
Otra estrategia para evitar el uso incorrecto de un reactivo en exceso es utilizar técnicas de medición precisas. Es importante utilizar equipos de medición confiables y calibrados correctamente para obtener resultados más exactos. Asimismo, se debe prestar atención al momento de dispensar los reactivos, evitando derrames o errores en la pipeteada.
Una vez que se ha determinado la cantidad adecuada de reactivo a utilizar, es fundamental seguir las indicaciones de manera precisa. Siguiendo las instrucciones paso a paso, evitaremos agregar una cantidad mayor de la necesaria y garantizaremos una reacción controlada y eficiente.
El uso incorrecto de un reactivo en exceso puede afectar negativamente los resultados de una reacción química. Para evitar este problema, es necesario comprender la estequiometría de la reacción, realizar pruebas de ensayo previas, utilizar técnicas de medición precisas y seguir las indicaciones cuidadosamente. Al hacerlo, estaremos asegurando la eficiencia y calidad de nuestras reacciones químicas en el laboratorio.
Cómo se puede calcular la cantidad de reactivo en exceso en una reacción química
El reactivo en exceso es un concepto crucial en las reacciones químicas que se produce cuando se agrega una cantidad más grande de reactivo del necesario para completar la reacción. Esto puede suceder por diferentes razones, como errores de medición, cálculos incorrectos o simplemente por precaución para asegurar que todo el reactivo principal se consuma completamente.
Calcular la cantidad de reactivo en exceso en una reacción química es fundamental para entender cómo se lleva a cabo la reacción y cómo afecta la formación de los productos. A continuación, se presentan los pasos necesarios para calcular esta cantidad:
Paso 1: Identificar el reactivo limitante
El reactivo limitante es aquel que se consume completamente durante la reacción y determina la cantidad máxima de producto que se puede formar. Para identificarlo, es necesario conocer las estequiometrías de los reactivos involucrados y comparar sus proporciones con las cantidades reales utilizadas.
Paso 2: Calcular la cantidad de reactivo utilizado
Una vez identificado el reactivo limitante, se debe calcular la cantidad exacta utilizada en la reacción. Esto se puede hacer utilizando la masa molar del reactivo, el número de moles utilizado y la estequiometría de la ecuación balanceada.
Ejemplo:
Si se tiene una reacción donde se mezclan 10 gramos de reactivo A con 20 gramos de reactivo B, y la estequiometría de la ecuación balanceada indica que se necesitan 2 moles de A por cada 3 moles de B, se debe calcular cuántos moles de A y B se utilizan en la reacción.
Para ello, se puede utilizar la siguiente fórmula:
Número de moles = Masa / Masa molar
Calculando los moles de A:
Número de moles de A = 10 g / Masa molar de A
Calculando los moles de B:
Número de moles de B = 20 g / Masa molar de B
Una vez obtenidos los moles de A y B, se puede determinar el reactivo limitante comparando sus proporciones según la estequiometría de la ecuación balanceada. En este caso, si se obtiene que hay una proporción de 2 moles de A por cada 4 moles de B, se puede concluir que el reactivo limitante es el reactivo B.
Paso 3: Calcular la cantidad de reactivo en exceso
Conocido el reactivo limitante y la cantidad utilizada, se puede determinar la cantidad de reactivo en exceso restante. Esto se puede hacer restando la cantidad utilizada del reactivo original utilizado en la reacción.
Ejemplo:
En el ejemplo anterior, si se utilizan completamente 10 moles de B como reactivo limitante, se puede calcular la cantidad de reactivo en exceso de A restante de la siguiente manera:
Cantidad de reactivo en exceso = Cantidad original de A - Cantidad utilizada de A
Si se tiene que la cantidad original de A es de 10 moles y se utilizan completamente 6 moles, se puede calcular que quedan 4 moles de A en exceso.
Es importante destacar que el reactivo en exceso no participa directamente en la formación del producto final y su presencia puede ser indeseable. Por eso, calcular su cantidad restante es fundamental para determinar la eficiencia de la reacción y poder realizar ajustes necesarios en futuros experimentos químicos.
Qué precauciones deben tomar los científicos al utilizar un reactivo en exceso en una reacción específica
El reactivo en exceso es un concepto crucial en el campo de la química y puede tener importantes implicaciones en una reacción química. Cuando los científicos hablan de un reactivo en exceso, se refieren a una situación en la cual uno o más de los reactivos necesarios para llevar a cabo una reacción están presentes en una cantidad mayor a la necesaria según los cálculos teóricos.
Si bien utilizar un reactivo en exceso puede ser beneficioso en algunos casos, como asegurar que la reacción se complete por completo o favorecer la formación de determinados productos, también puede tener consecuencias negativas si no se tienen las precauciones adecuadas.
Precauciones al utilizar un reactivo en exceso
1. Conocer la estequiometría de la reacción: Antes de decidir utilizar un reactivo en exceso, es importante conocer la estequiometría de la reacción. Esto implica tener una comprensión clara de las proporciones en las que los reactivos deben combinarse para obtener los productos deseados. Si se utilizan grandes cantidades de reactivo en exceso sin tener en cuenta la estequiometría, es posible que se obtengan resultados inesperados.
2. Evaluar la seguridad: Al utilizar un reactivo en exceso, es fundamental evaluar la seguridad de la manipulación y el almacenamiento de dichos reactivos. Algunos reactivos pueden ser peligrosos en grandes cantidades, por lo que es necesario seguir todas las normas de seguridad establecidas, usar los equipos de protección adecuados y realizar las medidas de control necesarias para evitar riesgos.
3. Controlar las condiciones de reacción: Utilizar un reactivo en exceso puede influir en las condiciones de la reacción, como la temperatura y el pH. Es fundamental controlar y ajustar estas condiciones según sea necesario para asegurar que la reacción progrese de manera óptima y se obtengan los resultados deseados.
4. Considerar el costo: Utilizar un reactivo en exceso implica utilizar mayores cantidades de dicho reactivo, lo cual puede tener implicaciones económicas. Antes de decidir si es conveniente utilizar un reactivo en exceso, los científicos deben considerar los costos asociados y evaluar si los beneficios compensan dichos gastos.
Utilizar un reactivo en exceso puede ser una estrategia útil en ciertas situaciones, pero requiere de precauciones adicionales por parte de los científicos. Conocer la estequiometría de la reacción, evaluar la seguridad, controlar las condiciones de reacción y considerar el costo son algunas de las precauciones clave que deben tomarse al utilizar un reactivo en exceso en una reacción química específica.
Cuáles son algunos ejemplos comunes de reacciones químicas en las que se utiliza un reactivo en exceso
En el mundo de la química, al realizar una reacción entre sustancias, es común utilizar una cantidad mayor de uno de los reactivos que se requieren para completar la reacción. A esta práctica se le conoce como "reactivo en exceso". El uso de un reactivo en exceso puede tener diferentes propósitos y beneficios en distintas reacciones químicas.
Existen numerosos ejemplos de reacciones en las que se utiliza un reactivo en exceso. Uno de los casos más conocidos es la reacción de neutralización entre un ácido y una base. Por ejemplo, cuando se mezcla ácido clorhídrico (HCl) y hidróxido de sodio (NaOH), el NaOH se suele agregar en exceso. Esto se debe a que, para lograr una neutralización completa, se necesita asegurar que todo el ácido haya sido neutralizado por la base. Al añadir un exceso de hidróxido de sodio, nos aseguramos de que no haya ácido presente al finalizar la reacción.
Otro ejemplo común se encuentra en las reacciones de precipitación. Cuando se desea obtener un sólido insoluble, es común utilizar un reactivo en exceso para garantizar la formación completa del precipitado deseado. Por ejemplo, al mezclar nitrato de plata (AgNO3) y cloruro de sodio (NaCl), se obtiene cloruro de plata (AgCl) como precipitado. Sin embargo, para asegurar que todo el nitrato de plata reaccione y se forme la mayor cantidad posible de AgCl, se utiliza cloruro de sodio en exceso.
En el campo de la síntesis orgánica, también se emplea el reactivo en exceso en muchas reacciones. Por ejemplo, al realizar una reacción de esterificación para obtener un éster, se emplea un exceso de ácido carboxílico con el fin de favorecer la formación del producto deseado. El reactivo en exceso ayuda a desplazar el equilibrio de la reacción hacia la formación del éster.
Hay numerosos ejemplos en los que se utiliza un reactivo en exceso en reacciones químicas. Ya sea para asegurar una neutralización completa, obtener precipitados completos o favorecer la formación de un producto específico, el uso del reactivo en exceso es una práctica común y crucial en el ámbito de la química.
Preguntas frecuentes (FAQ)
1. ¿Qué significa tener un reactivo en exceso en una reacción química?
Tener un reactivo en exceso significa que se ha añadido más cantidad de ese reactivo del necesario para completar la reacción.
2. ¿Cuál es el propósito de utilizar un reactivo en exceso en una reacción química?
El uso de un reactivo en exceso puede aumentar el rendimiento de la reacción y asegurar que la reacción esté completa.
3. ¿Qué problemas puede causar un reactivo en exceso en una reacción química?
Un reactivo en exceso puede causar la formación de subproductos no deseados, desperdiciar material y afectar negativamente el costo económico de la reacción.
4. ¿Cómo se determina cuánto reactivo en exceso se debe utilizar?
La cantidad de reactivo en exceso depende de la estequiometría de la reacción y puede calcularse utilizando las proporciones molares de los reactivos.
5. ¿Hay algún método para eliminar un reactivo en exceso después de la reacción?
En algunos casos, es posible eliminar un reactivo en exceso mediante métodos como destilación, extracción o filtración.

Deja una respuesta