Descubre todo sobre la capa de valencia y cómo determina las propiedades de los elementos químicos
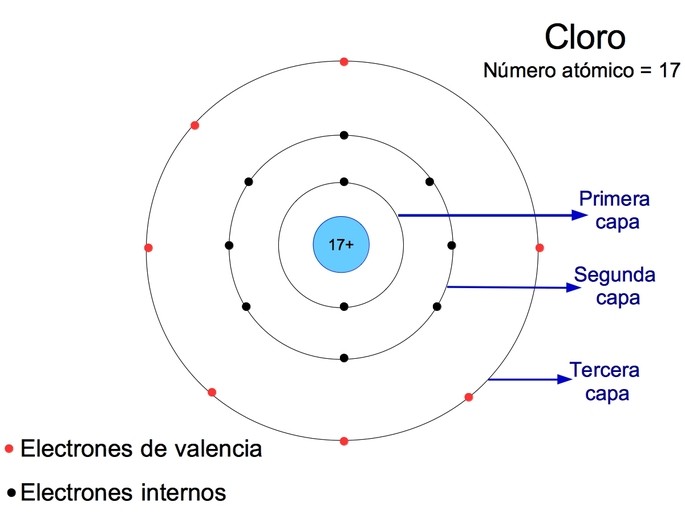
En química, la capa de valencia es una estructura específica de electrones que rodea el núcleo de un átomo y determina las propiedades químicas de un elemento. La capa de valencia está compuesta por los electrones más externos de un átomo, es decir, aquellos ubicados en los niveles energéticos más altos. Estos electrones son los responsables de las reacciones químicas y de la formación de enlaces con otros átomos.
Exploraremos con mayor detalle qué es la capa de valencia, cómo se determina su configuración electrónica y cómo influye en las propiedades químicas de los elementos. También analizaremos algunos ejemplos concretos para comprender mejor la importancia de la capa de valencia en la química. Es fundamental entender cómo funcionan estas capas para entender, por ejemplo, por qué ciertos elementos tienen afinidad por formar enlaces y otros no, o por qué algunos metales son buenos conductores de electricidad mientras que otros no.
- Qué es la capa de valencia en un átomo y por qué es importante
- Cómo se determina la cantidad de electrones en la capa de valencia de un elemento químico
- Cuál es la relación entre la ubicación de un elemento en la tabla periódica y su número de electrones en la capa de valencia
- Qué propiedades de los elementos químicos son influenciadas por su capa de valencia
- Por qué algunos elementos tienen mayor reactividad que otros debido a su capa de valencia
- Cómo los electrones en la capa de valencia pueden participar en las reacciones químicas y formar enlaces con otros átomos
- Cuál es la importancia de comprender la capa de valencia en términos de predicción de comportamiento químico de los elementos
- Cómo podemos utilizar la información sobre la capa de valencia para diseñar nuevos materiales con propiedades específicas
- Qué papel juega la capa de valencia en la formación de iones y en la carga eléctrica de un átomo
- Cómo influye la capa de valencia en la conductividad eléctrica y térmica de los materiales
Qué es la capa de valencia en un átomo y por qué es importante
La capa de valencia es la capa más externa de un átomo, donde se encuentran los electrones de mayor energía. Estos electrones son conocidos como electrones de valencia y son los responsables de las propiedades químicas de los elementos.
Los electrones de valencia determinan cómo se combinan los átomos para formar compuestos químicos y qué tipo de enlace se forma entre ellos. Además, también influyen en otras propiedades físicas y químicas de los elementos, como el punto de fusión, el punto de ebullición y la conductividad eléctrica.
La capa de valencia puede contener hasta 8 electrones, excepto para los elementos de la primera fila de la tabla periódica (hidrógeno y helio), que solo pueden tener 2 electrones en su capa de valencia.
Los electrones de valencia son los primeros en participar en las reacciones químicas, ya que son los más "sueltos" y los más accesibles para interactuar con otros átomos. Esto significa que los electrones de valencia son cruciales para entender cómo los elementos se comportan en diferentes situaciones químicas.
Cómo determinar la cantidad de electrones de valencia
La cantidad de electrones de valencia en un átomo se puede determinar mirando la posición del elemento en la tabla periódica. Los elementos en la misma columna o grupo tienen la misma cantidad de electrones de valencia.
Por ejemplo, los elementos en el grupo 1 tienen 1 electrón de valencia, mientras que los elementos en el grupo 2 tienen 2 electrones de valencia. De manera similar, los elementos en el grupo 17 tienen 7 electrones de valencia y los elementos en el grupo 18 (gases nobles) tienen 8 electrones de valencia.
Para los elementos de transición, determinar la cantidad de electrones de valencia puede ser un poco más complicado, ya que estos elementos no siguen un patrón tan claro. En general, los electrones de valencia en los elementos de transición se encuentran en las subcapas s y d.
Importancia de la capa de valencia en la formación de enlaces
La capa de valencia es crucial en la formación de enlaces químicos. Los átomos tienden a perder, ganar o compartir electrones para completar su capa de valencia y alcanzar una configuración electrónica estable.
Los elementos con pocos electrones en su capa de valencia tienden a perder esos electrones y formar iones positivos. Por otro lado, los elementos con casi una capa completa tienden a ganar electrones y formar iones negativos.
Además de la formación de iones, los electrones de valencia también son responsables de la formación de enlaces covalentes, donde dos átomos comparten pares de electrones para completar sus capas de valencia.
La capa de valencia es fundamental en la determinación de las propiedades químicas de los elementos. Los electrones de valencia juegan un papel crucial en la formación de enlaces químicos y en las reacciones químicas en general. Comprender cómo funcionan los electrones de valencia nos permite explicar y predecir el comportamiento químico de los elementos y sus compuestos.
Cómo se determina la cantidad de electrones en la capa de valencia de un elemento químico
La capa de valencia es la capa más externa de un átomo, y está compuesta por los electrones que participan en una reacción química. Determinar la cantidad de electrones en la capa de valencia de un elemento químico es crucial para comprender sus propiedades y su comportamiento en una variedad de reacciones químicas.
Para determinar la cantidad de electrones en la capa de valencia de un elemento químico, es necesario examinar la estructura electrónica del átomo. La estructura electrónica se refiere a la distribución de electrones en los diferentes niveles y subniveles de energía que rodean al núcleo atómico.
En primer lugar, es importante recordar que cada nivel de energía puede contener un número máximo de electrones. El primer nivel, conocido como nivel K, puede contener hasta 2 electrones; el segundo nivel, llamado nivel L, puede contener hasta 8 electrones; el tercer nivel, llamado nivel M, puede contener hasta 18 electrones; y así sucesivamente.
Una vez que se conoce la estructura electrónica del átomo, se puede determinar la cantidad de electrones en la capa de valencia utilizando la regla del octeto. Según esta regla, los elementos tienden a adquirir configuraciones electrónicas estables llenando o vaciando su capa de valencia para alcanzar una configuración similar a la de los gases nobles.
Si un átomo tiene menos de 4 electrones en su capa de valencia, es probable que pierda esos electrones para obtener una configuración electrónica estable. Esto se observa comúnmente en los metales. Por ejemplo, el sodio tiene 1 electrón en su capa de valencia y tiende a perderlo para adquirir una configuración similar a la del gas noble más cercano, que es el neón.
Por otro lado, si un átomo tiene más de 4 electrones en su capa de valencia, es probable que gane electrones para alcanzar una configuración electrónica estable. Esto se observa comúnmente en los no metales. Por ejemplo, el oxígeno tiene 6 electrones en su capa de valencia y tiende a ganar 2 electrones para obtener una configuración similar a la del gas noble más cercano, que es el neón.
Es importante destacar que hay excepciones a la regla del octeto, especialmente para elementos ubicados en la fila del periodo 3 o superior. Estos elementos pueden tener más de 8 electrones en su capa de valencia debido a la presencia de orbitales d adicionales.
La determinación de la cantidad de electrones en la capa de valencia de un elemento químico es crucial para comprender sus propiedades y su comportamiento en las reacciones químicas. La estructura electrónica del átomo y la regla del octeto son herramientas importantes para determinar esta información. Sin embargo, es importante recordar que existen excepciones a la regla del octeto, especialmente para elementos ubicados en periodos superiores.
Cuál es la relación entre la ubicación de un elemento en la tabla periódica y su número de electrones en la capa de valencia
La tabla periódica de los elementos es una herramienta fundamental en el estudio de la química. En ella, los elementos están organizados en filas y columnas de acuerdo a sus propiedades químicas y físicas. Una de las características más importantes que determina estas propiedades es el número de electrones en la capa de valencia.
La capa de valencia es la última capa de electrones en un átomo y está involucrada en la formación de enlaces químicos. Esta capa determina la forma en que los átomos interactúan entre sí y cómo se comportan los elementos en reacciones químicas. Los elementos se dividen en diferentes grupos según la cantidad de electrones en su capa de valencia.
Grupos 1 y 2: Los metales alcalinos y alcalinotérreos
Los elementos del grupo 1, también conocidos como los metales alcalinos, tienen un solo electrón en su capa de valencia. Estos elementos son altamente reactivos debido a su tendencia a perder este electrón y formar iones positivos. Por ejemplo, el sodio (Na) tiene un electrón en su capa de valencia y tiende a perder este electrón para alcanzar la configuración electrónica estable del gas noble neón.
Por otro lado, los elementos del grupo 2, llamados metales alcalinotérreos, tienen dos electrones en su capa de valencia. Al igual que los metales alcalinos, estos elementos son reactivos y tienden a perder estos electrones para formar iones positivos. El magnesio (Mg), por ejemplo, tiene dos electrones en su capa de valencia y tiende a perderlos para alcanzar la configuración electrónica estable del gas noble argón.
Grupos 13 a 18: Los elementos de transición y los gases nobles
En los grupos del 13 al 18 se encuentran los elementos de transición y los gases nobles. Estos elementos tienen una capa de valencia con diferentes números de electrones, lo que les confiere propiedades únicas.
Los elementos de transición, ubicados en los grupos 3 a 12, tienen una variedad de electrones en su capa de valencia. Estos elementos son conocidos por su alta conductividad eléctrica y térmica, así como por su alta maleabilidad y ductilidad. Algunos ejemplos de elementos de transición son el hierro (Fe) y el cobalto (Co).
Por otro lado, los gases nobles, en el grupo 18, tienen ocho electrones en su capa de valencia, lo que les otorga estabilidad y poca reactividad química. Estos elementos son conocidos por su uso en iluminación y en láseres. El helio (He), por ejemplo, tiene dos electrones en su capa de valencia y es ampliamente utilizado en globos y dirigibles debido a su baja densidad.
Otros grupos de la tabla periódica
Existen otros grupos en la tabla periódica con diferentes configuraciones electrónicas en la capa de valencia. Estos grupos incluyen los grupos 14 a 17, donde se encuentran los elementos no metales, y el grupo de los lantánidos y actínidos, que son metales del bloque f.
Los elementos no metales, ubicados en los grupos 14 a 17, tienen una variedad de electrones en su capa de valencia. Estos elementos tienden a ganar electrones para formar iones negativos y tienen propiedades como baja conductividad eléctrica y baja densidad. Algunos ejemplos de elementos no metales son el carbono (C) y el oxígeno (O).
Por último, los lantánidos y actínidos, ubicados debajo de la tabla periódica, son una serie de elementos muy reactivos y radioactivos. Estos elementos también tienen diversos números de electrones en su capa de valencia y se utilizan en aplicaciones nucleares y tecnológicas.
El número de electrones en la capa de valencia es un factor crucial que determina las propiedades químicas y físicas de los elementos. A través de esta información, los científicos pueden predecir cómo los átomos interactuarán y experimentarán cambios en diferentes reacciones químicas.
Qué propiedades de los elementos químicos son influenciadas por su capa de valencia
La capa de valencia de un átomo es la capa más externa de electrones en su estructura electrónica. Estos electrones de valencia juegan un papel crucial en la determinación de las propiedades químicas y físicas de los elementos.
Una de las propiedades más importantes influenciadas por la capa de valencia es el potencial de ionización. El potencial de ionización se refiere a la energía necesaria para remover un electrón de valencia de un átomo. Los elementos con una capa de valencia completa tienden a tener un alto potencial de ionización, ya que sus electrones de valencia están fuertemente atraídos por el núcleo del átomo. Los elementos con una capa de valencia incompleta tienen un potencial de ionización menor, ya que sus electrones de valencia son más fáciles de remover.
Otra propiedad influenciada por la capa de valencia es la electronegatividad. La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo. Los elementos con una alta electronegatividad generalmente tienen una capa de valencia casi completa o incompleta. Esto les permite atraer electrones de otros átomos con mayor facilidad, lo que resulta en enlaces químicos más fuertes y polarizados. Por otro lado, los elementos con baja electronegatividad tienden a tener una capa de valencia completa, lo que dificulta la atracción de electrones adicionales.
La reactividad química también está estrechamente relacionada con la capa de valencia. Los elementos con una capa de valencia incompleta tienden a ser altamente reactivos, ya que tienden a ganar o perder electrones para alcanzar la configuración electrónica estable de un gas noble. Estos elementos buscan completar su capa de valencia mediante enlaces químicos con otros átomos. Por otro lado, los elementos con una capa de valencia completa son menos reactivos, ya que no necesitan ganar ni perder electrones.
Además, la capacidad de formar compuestos químicos está determinada por la capa de valencia. Los elementos con una capa de valencia incompleta tienen más posibilidades de formar compuestos debido a su disposición para compartir o transferir electrones con otros átomos. Esto les permite formar enlaces químicos y crear compuestos estables. Por otro lado, los elementos con una capa de valencia completa tienen menos tendencia a formar compuestos, ya que no necesitan interactuar con otros átomos para alcanzar la estabilidad.
Influencia en las propiedades físicas
No solo las propiedades químicas, sino también las propiedades físicas de los elementos están influenciadas por su capa de valencia. La capa de valencia afecta el tamaño del átomo, la densidad y el punto de ebullición, entre otras propiedades físicas.
Por qué algunos elementos tienen mayor reactividad que otros debido a su capa de valencia
La capa de valencia es una capa externa de electrones que rodea al núcleo de un átomo. Los electrones en esta capa son los responsables de las propiedades químicas de un elemento y determinan su reactividad. Algunos elementos tienen una mayor reactividad que otros debido a la configuración de su capa de valencia.
Para entender esto, es importante recordar cómo se estructura un átomo. Los átomos están compuestos por un núcleo central que contiene protones y neutrones, y una serie de capas electrónicas alrededor del núcleo que contienen electrones. Cada capa puede contener un número máximo de electrones:
- La primera capa, más cercana al núcleo, puede contener hasta 2 electrones.
- La segunda capa puede contener hasta 8 electrones.
- La tercera capa, y las siguientes, también pueden contener hasta 8 electrones.
El comportamiento químico de un elemento está determinado principalmente por su capa de valencia, que es la capa más externa y está incompleta en la mayoría de los casos. La estabilidad de un átomo depende de cuántos electrones haya en su capa de valencia y de si esta está completa o no. Si la capa de valencia está completa con el número máximo de electrones, el átomo será electrónico célula y no reaccionará fácilmente con otros átomos. Esto explica por qué los gases nobles, como el helio y el neón, son menos reactivos.
Por otro lado, si la capa de valencia está incompleta, el átomo será más reactivo, ya que buscará interactuar con otros átomos para completar su capa de valencia y alcanzar una mayor estabilidad. Esto explica por qué algunos elementos son muy reactivos y se combinan fácilmente con otros elementos para formar compuestos químicos.
La capacidad de un átomo para ganar, perder o compartir electrones con otros átomos depende de cuántos electrones necesita para completar su capa de valencia. Los elementos en la misma columna de la tabla periódica tienen configuraciones de capa de valencia similares, lo que significa que tienen propiedades químicas y reactividades similares. Por ejemplo, todos los elementos en la columna 17, conocida como los halógenos, tienen 7 electrones en su capa de valencia y tienden a ganar un electrón para completarla.
La capa de valencia es fundamental para comprender las propiedades químicas de los elementos. La presencia de electrones en esta capa determina la reactividad de un átomo y su capacidad para formar compuestos químicos. Entender cómo funciona la capa de valencia nos ayuda a explicar por qué algunos elementos son más reactivos que otros y cómo se forman diferentes compuestos químicos.
Cómo los electrones en la capa de valencia pueden participar en las reacciones químicas y formar enlaces con otros átomos
La capa de valencia juega un papel crucial en la determinación de las propiedades químicas de los elementos. Esta capa, también conocida como última capa o capa externa, es la que contiene los electrones más energéticos y es responsable de la forma en que los átomos interactúan entre sí.
Los electrones en la capa de valencia son los encargados de participar en las reacciones químicas y formar enlaces con otros átomos. Estos electrones pueden ser compartidos, donados o recibidos, lo que da lugar a la formación de diferentes tipos de enlaces químicos, como enlaces iónicos, covalentes o metálicos.
En el caso de los átomos con pocos electrones en su capa de valencia, tienden a perder o ganar electrones para lograr una configuración electrónica más estable. Por ejemplo, el sodio (Na) tiene un electrón en su capa de valencia, por lo que tiende a perder este electrón y adquirir una carga positiva para llegar a la configuración del gas noble más cercano, que en este caso es el neón.
Por otro lado, los átomos con casi todos los electrones de su capa de valencia ocupados, tienden a compartir electrones con otros átomos para completar dicha capa y alcanzar una configuración electrónica estable. El oxígeno (O), por ejemplo, tiene 6 electrones en su capa de valencia y necesita 2 electrones adicionales para completarla. Por ello, el oxígeno forma enlaces covalentes con otros átomos, compartiendo electrones para lograr la estabilidad.
La capa de valencia también determina el número de oxidación de un elemento, que es la carga eléctrica que adquiere cuando forma un compuesto. Los elementos químicos tienden a alcanzar una configuración electrónica estable al perder, ganar o compartir electrones, y esto se ve reflejado en su número de oxidación.
Además, la cantidad de electrones en la capa de valencia influye en otras propiedades de los elementos, como su reactividad química, el tamaño del átomo y su capacidad para formar diferentes tipos de enlaces químicos. Por ejemplo, los elementos en el grupo 1 de la tabla periódica, también conocidos como metales alcalinos, tienen un solo electrón en su capa de valencia y son extremadamente reactivos.
La capa de valencia de los átomos determina cómo interactúan con otros átomos y cómo forman enlaces químicos. Los electrones en esta capa pueden ser compartidos, donados o recibidos, lo que da lugar a diferentes tipos de enlaces y propiedades químicas. La comprensión de la capa de valencia es fundamental para entender las propiedades y comportamiento de los elementos químicos.
Cuál es la importancia de comprender la capa de valencia en términos de predicción de comportamiento químico de los elementos
La capa de valencia es uno de los conceptos más fundamentales en química. Comprender y analizar la estructura electrónica de los elementos puede permitirnos predecir su comportamiento químico y entender sus propiedades físicas y químicas.
En términos sencillos, la capa de valencia de un átomo es la última capa electrónica ocupada por electrones. Estos electrones son los responsables de las interacciones químicas del elemento con otros elementos y compuestos. Por lo tanto, conocer la cantidad de electrones de valencia nos brinda información valiosa sobre cómo el elemento interactuará con su entorno.
La capa de valencia también determina la reactividad de un elemento. Los electrones de valencia son los más alejados del núcleo y experimentan una fuerza de atracción relativamente débil. Esto significa que pueden ser compartidos, transferidos o eliminados más fácilmente durante una reacción química. Como resultado, los elementos con pocos electrones de valencia tienden a ser altamente reactivos, mientras que aquellos con una capa de valencia completa (8 electrones en total, excepto para el hidrógeno) tienden a ser inertes y poco reactivos.
La capa de valencia también influye en otras propiedades físicas y químicas de los elementos. Por ejemplo, determina la capacidad de conducir electricidad de los elementos en estado sólido o líquido, así como su punto de fusión y ebullición. Además, la configuración electrónica de la capa de valencia es la base del sistema de clasificación periódica, ya que los elementos con configuraciones similares tienden a tener propiedades y comportamientos químicos similares.
Cómo determinar la cantidad de electrones de valencia
Para determinar la cantidad de electrones de valencia de un elemento, necesitamos conocer su configuración electrónica. La configuración electrónica nos dice cómo están distribuidos los electrones en las distintas capas alrededor del núcleo del átomo.
La forma más común de representar la configuración electrónica de un elemento es utilizando el diagrama de electrones o la notación de nivel y subnivel (números cuánticos). En ambos casos, los electrones se distribuyen en diferentes capas numeradas (1, 2, 3, etc.) y subniveles (s, p, d, f) dentro de cada capa.
Los electrones de la capa de valencia son aquellos ubicados en el último nivel principal (capa) y en el último subnivel (s o p). Por ejemplo, si tomamos el caso del carbono (C), su configuración electrónica básica es 1s2 2s2 2p2. Aquí, los dos electrones en la capa 1s no están en la capa de valencia, mientras que los cuatro electrones restantes (dos en 2s y dos en 2p) sí lo están. Por lo tanto, el carbono tiene 4 electrones de valencia.
Existen diversas formas de representar la cantidad de electrones de valencia de un elemento, ya sea mediante puntos de Lewis, números romanos o simplemente indicando la cantidad. Independientemente de la representación utilizada, conocer el número de electrones de valencia es fundamental para comprender cómo se interactuará un elemento específico en una reacción química.
La relación entre la capa de valencia y las propiedades periódicas
Como mencionamos anteriormente, la capa de valencia influye en las propiedades periódicas de los elementos. La configuración electrónica de la capa de valencia determina cómo será la reactividad química de un elemento y cómo se comportará en diferentes circunstancias.
En la tabla periódica, los elementos están dispuestos en orden creciente según su número atómico (la cantidad de protones que tienen en su núcleo). A medida que avanzamos en grupos o columnas verticales, observamos similitudes en las configuraciones electrónicas de los elementos. Esta similitud indica una tendencia en sus propiedades químicas y físicas.
Los elementos en el mismo grupo tienen la misma cantidad de electrones de valencia y, por lo tanto, presentan características químicas similares. Por ejemplo, todos los elementos del Grupo 1 (metales alcalinos), como el litio, el sodio y el potasio, tienen un solo electrón de valencia en su capa externa. Como resultado, estos elementos son altamente reactivos y tienden a perder ese único electrón de valencia para formar cationes positivos con carga +1.
Por otro lado, los elementos en el Grupo 18 (gases nobles), como el helio, el neón, el argón, tienen una capa de valencia completa, lo que significa que tienen una configuración electrónica estable y son poco reactivos. Esta estabilidad se debe a que sus capas externas están completamente llenas de electrones.
La capa de valencia es fundamental para predecir el comportamiento químico y entender las propiedades de los elementos. A través de su análisis, podemos determinar qué tan reactivo será un elemento, cómo se formarán los compuestos y en qué medida variarán sus propiedades físicas.
Cómo podemos utilizar la información sobre la capa de valencia para diseñar nuevos materiales con propiedades específicas
La capa de valencia es una capa electrónica en los átomos que determina la forma en que interactúan con otros átomos y las propiedades químicas de los elementos. Comprender cómo funciona la capa de valencia nos brinda información valiosa sobre los elementos y nos permite diseñar nuevos materiales con propiedades específicas.
La capa de valencia contiene los electrones más externos de un átomo, aquellos que están más lejos del núcleo. Estos electrones son los responsables de la formación de enlaces químicos, lo que significa que son fundamentales para determinar cómo los átomos se unen entre sí para formar compuestos. La configuración de la capa de valencia de un átomo influye en su reactividad química y en sus propiedades físicas.
Una manera de utilizar la información sobre la capa de valencia para diseñar nuevos materiales es mediante la manipulación de los niveles de energía de los electrones en esta capa. Cuando comprendemos cómo se distribuyen los electrones en la capa de valencia de un átomo, podemos modificar los enlaces químicos y crear materiales con propiedades únicas.
Ejemplo de aplicación práctica: diseño de materiales conductores de electricidad
Uno de los ejemplos más conocidos de cómo la información sobre la capa de valencia puede usarse para diseñar materiales es en la creación de materiales conductores de electricidad.
Los materiales conductores, como el cobre o la plata, tienen una capa de valencia con electrones libres que pueden moverse fácilmente a través del material. Estos electrones libres permiten el flujo de la corriente eléctrica.
Al entender cómo los electrones se distribuyen y se mueven en la capa de valencia de los elementos conductores, los científicos pueden diseñar materiales que tienen la capacidad de conducir la electricidad de manera más eficiente o con propiedades específicas. Por ejemplo, ajustando la cantidad de electrones libres en la capa de valencia de un material conductor, los científicos pueden crear materiales superconductores, que pueden conducir la electricidad sin resistencia alguna.
La información sobre la capa de valencia es fundamental para comprender las propiedades de los elementos químicos y puede ser utilizada para diseñar nuevos materiales con propiedades específicas. La manipulación de la capa de valencia nos permite crear materiales con características únicas, como conductividad eléctrica mejorada o propiedades magnéticas específicas. El estudio de la capa de valencia es una herramienta importante en el campo de la ciencia de materiales y tiene aplicaciones en numerosos campos, desde la electrónica hasta la química industrial.
Qué papel juega la capa de valencia en la formación de iones y en la carga eléctrica de un átomo
La capa de valencia es la capa más externa de un átomo y juega un papel crucial en la formación de iones y en la carga eléctrica de un átomo. Esta capa contiene los electrones más energéticos y determina las propiedades químicas de un elemento.
Los electrones en la capa de valencia son los responsables de las interacciones químicas entre átomos, ya que participan en la formación de enlaces químicos. La cantidad de electrones en esta capa determina si un átomo es estable o reactivamente inestable.
Un átomo busca alcanzar la estabilidad electrónica al completar su capa de valencia, lo que significa tener el número máximo de electrones permitidos en dicha capa. La regla del octeto establece que los elementos tienden a ganar, perder o compartir electrones para lograr la configuración electrónica de los gases nobles, que tienen una capa de valencia completa.
Cuando un átomo pierde electrones de su capa de valencia, adquiere una carga positiva y se convierte en un catión. Por otro lado, cuando un átomo gana electrones en su capa de valencia, adquiere una carga negativa y se convierte en un anión. Estas transferencias de electrones son fundamentales en la formación de compuestos iónicos.
Propiedades de los elementos químicos según su capa de valencia
La capa de valencia también determina muchas de las propiedades físicas y químicas de los elementos. La posición de un elemento en la tabla periódica está relacionada con el número de electrones en su capa de valencia. Esta posición influye en la reactividad, conductividad eléctrica, puntos de fusión y ebullición, entre otras propiedades.
Los elementos con una capa de valencia completa, como los gases nobles, son muy estables y poco reactivos. Tienen poca tendencia a formar enlaces químicos con otros elementos. Por otro lado, los elementos que tienen pocos electrones en su capa de valencia tienden a ser más reactivos, ya que buscan ganar o perder electrones para alcanzar la estabilidad electrónica.
Además de influir en la reactividad, la capa de valencia también afecta la conductividad eléctrica de los elementos. Los metales tienden a tener pocos electrones en su capa de valencia y son buenos conductores de electricidad. Esto se debe a que los electrones de su capa de valencia están débilmente unidos y pueden moverse libremente a través del material.
En contraste, los no metales tienen una capa de valencia casi llena o completamente llena, lo que los hace malos conductores de electricidad. En lugar de electrones libres en su capa de valencia, los no metales tienden a compartir electrones con otros átomos para formar enlaces covalentes.
La capa de valencia juega un papel fundamental en la formación de iones y en la carga eléctrica de un átomo. Además, determina muchas de las propiedades químicas y físicas de los elementos, como su reactividad, conductividad eléctrica y puntos de fusión y ebullición. Es un concepto central en la comprensión de la química y la forma en que los átomos interactúan para formar compuestos.
Cómo influye la capa de valencia en la conductividad eléctrica y térmica de los materiales
La capa de valencia es fundamental para entender las propiedades de los materiales, especialmente en lo que respecta a su conductividad eléctrica y térmica. Esta capa, también conocida como última capa electrónica o nivel energético externo, está compuesta por los electrones más externos de un átomo.
En términos simples, la conductividad eléctrica se refiere a la capacidad de un material para permitir el flujo de corriente eléctrica. La capa de valencia desempeña un papel clave en este proceso, ya que determina si un material será conductor, semiconductor o aislante.
Los metales, por ejemplo, tienen una capa de valencia que contiene pocos electrones, generalmente de uno a tres, y estos electrones pueden moverse libremente por todo el material. Esto les confiere una alta conductividad eléctrica, ya que los electrones pueden transportar carga eléctrica de manera eficiente.
Los semiconductores, por otro lado, tienen una capa de valencia que está parcialmente llena, pero no completamente. Esto significa que algunos electrones pueden moverse, pero no con tanta libertad como en los metales. Estos materiales presentan una conductividad eléctrica intermedia y se utilizan ampliamente en dispositivos electrónicos como transistores y circuitos integrados.
Por último, los aislantes tienen una capa de valencia completamente llena, lo que significa que los electrones están fuertemente ligados al núcleo del átomo y no pueden moverse fácilmente. Esto evita la transferencia eficiente de cargas eléctricas a través del material, lo que los convierte en malos conductores de electricidad.
En cuanto a la conductividad térmica, la capa de valencia también tiene una influencia significativa. La conductividad térmica se refiere a la capacidad de un material para conducir el calor. Los electrones en la capa de valencia pueden transferir energía térmica mediante colisiones con otros electrones y átomos.
Los metales, una vez más, destacan en este aspecto debido a su estructura cristalina y sus electrones móviles. Cuando se agrega energía térmica al material, los electrones en la capa de valencia pueden moverse rápidamente y transferir esa energía a otras partículas cercanas, facilitando así la conducción del calor.
Los semiconductores y aislantes, por otro lado, tienen menor conductividad térmica en comparación con los metales. Esto se debe a que sus capas de valencia están ocupadas o parcialmente ocupadas, lo que dificulta el movimiento libre de los electrones y la transferencia de energía térmica.
La capa de valencia juega un papel crucial en las propiedades de conductividad eléctrica y térmica de los materiales. Dependiendo de la cantidad de electrones presentes en esta capa y su capacidad para moverse, un material puede ser conductor, semiconductor o aislante. El estudio de la capa de valencia es esencial para comprender y diseñar materiales con propiedades específicas para aplicaciones tecnológicas y científicas.
La capa de valencia es la última capa electrónica en un átomo que contiene electrones. Determina las propiedades químicas y reactividad del elemento.
La cantidad de electrones en la capa de valencia corresponde al número del grupo en la tabla periódica. Por ejemplo, los elementos del Grupo 1 tienen un electrón en la capa de valencia.
La capa de valencia determina la facilidad con la que un átomo puede perder, ganar o compartir electrones para formar enlaces químicos. Esto afecta a las propiedades de los compuestos formados.
El número de oxidación de un elemento depende de su capacidad para perder, ganar o compartir electrones en su capa de valencia. Algunos elementos pueden formar diferentes tipos de enlaces y, por tanto, diferentes números de oxidación.
Cuando elementos con diferentes números de oxidación se combinan, pueden formar compuestos iónicos o covalentes. En los compuestos iónicos, uno de los elementos pierde electrones y se convierte en un catión, mientras que el otro elemento gana electrones y se convierte en un anión.

Deja una respuesta