Electronegatividad: Descubre cómo varía en la Tabla Periódica y domina la química de los elementos
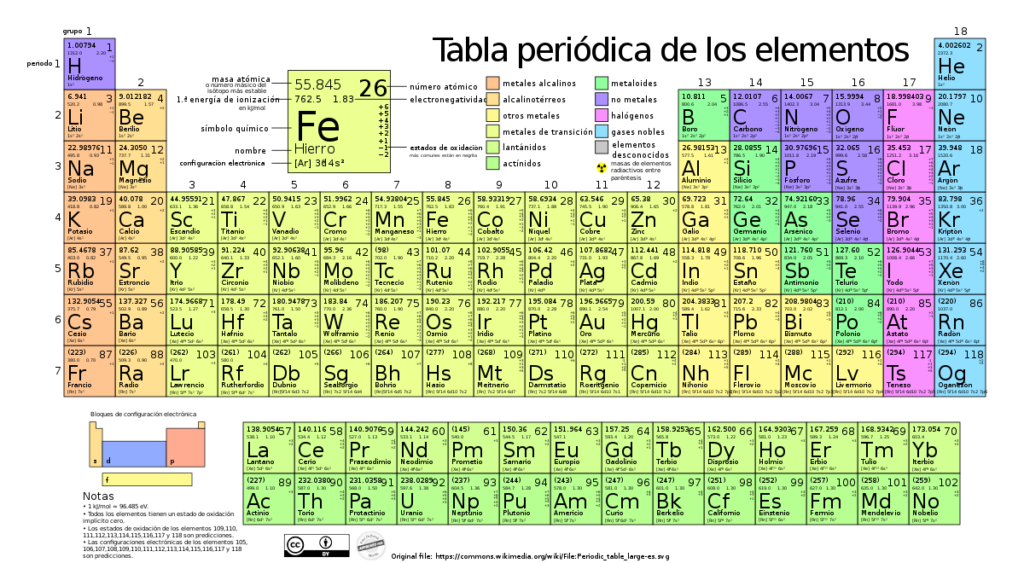
La electronegatividad es una propiedad química fundamental que describe la capacidad de un átomo para atraer electrones en una molécula. Es una medida de la tendencia de los átomos a atraer o compartir electrones enlazantes y es clave para entender la naturaleza de las interacciones químicas. La electronegatividad varía en la tabla periódica, lo que tiene una gran influencia en los diferentes comportamientos y propiedades de los elementos.
Te explicaremos cómo varía la electronegatividad a lo largo de la tabla periódica y cómo esta variación impacta en la química de los elementos. Además, profundizaremos en la relación entre la electronegatividad y otros conceptos importantes, como la polaridad de los enlaces químicos y la formación de compuestos iónicos o covalentes. Conocer la electronegatividad es esencial para comprender y predecir el comportamiento químico de los elementos y sus compuestos, lo que nos ayuda a entender mejor el mundo de la química.
- Qué es la electronegatividad y por qué es importante en química
- Cómo varía la electronegatividad a lo largo de la Tabla Periódica
- Cuáles son los elementos más electronegativos y menos electronegativos
- Cómo afecta la electronegatividad a la formación de enlaces químicos
- Cuál es la relación entre la electronegatividad y las propiedades físicas de los elementos
- Puede la electronegatividad predecir la polaridad de una molécula
- Cuál es el impacto de la electronegatividad en la solubilidad y reactividad de los compuestos químicos
- Cómo se utiliza la electronegatividad para determinar la geometría molecular
- Hay alguna excepción a la tendencia general de electronegatividad en la Tabla Periódica
- Cómo podemos utilizar la electronegatividad para predecir el comportamiento químico de los elementos en una reacción
- Preguntas frecuentes (FAQ)
Qué es la electronegatividad y por qué es importante en química
La electronegatividad es una propiedad química que describe la capacidad de un átomo para atraer electrones en un enlace covalente. En otras palabras, indica cuánta tendencia tiene un átomo de atraer los electrones compartidos en una molécula. Esta propiedad es fundamental en química ya que influye en numerosos aspectos de las interacciones entre átomos y moléculas.
La electronegatividad de los elementos varía a lo largo de la Tabla Periódica. Esto se debe principalmente a la carga nuclear efectiva, es decir, la atracción ejercida por el núcleo atómico sobre los electrones de la capa más externa. En general, los elementos no metales tienden a ser más electronegativos que los metales. Además, dentro de un mismo grupo o familia, la electronegatividad disminuye al aumentar el número atómico.
Factores que afectan la electronegatividad
Existen diversos factores que pueden influir en el valor de la electronegatividad de un elemento. Uno de los principales es el tamaño del átomo. A medida que aumenta el radio atómico, la electronegatividad tiende a disminuir. Esto se debe a que los electrones se encuentran más lejos del núcleo y, por lo tanto, experimentan una menor atracción electrostática.
Otro factor importante es la carga nuclear efectiva. Cuanto mayor sea la carga nuclear efectiva, mayor será la electronegatividad. Esto se debe a que un mayor número de protones en el núcleo ejerce una mayor atracción sobre los electrones de la capa más externa.
Asimismo, la electronegatividad también puede estar influenciada por la presencia de otros átomos en una molécula. Los átomos más electronegativos tienden a atraer con más fuerza los electrones compartidos en un enlace covalente, generando desplazamientos de carga parcial y creando polos positivos y negativos en la molécula.
Aplicaciones de la electronegatividad
La electronegatividad tiene numerosas aplicaciones en química. Una de ellas es la determinación del tipo de enlace que se forma entre dos átomos. Si la diferencia de electronegatividad entre los átomos es baja (menor a 1.7), se forma un enlace covalente. En cambio, si la diferencia es alta, se forma un enlace iónico. Esta información es fundamental para comprender las propiedades físicas y químicas de las sustancias.
Otra aplicación importante es la predicción de la polaridad de las moléculas. Cuando existe una diferencia de electronegatividad entre los átomos, se genera un desplazamiento de carga parcial que da lugar a una molécula polar. En cambio, si los átomos tienen una electronegatividad similar, la molécula será no polar.
Además, la electronegatividad también está relacionada con la capacidad de oxidación y reducción de un elemento. Los elementos más electronegativos suelen ser buenos oxidantes, mientras que los menos electronegativos son buenos reductores.
- La electronegatividad es una propiedad fundamental en química que describe la capacidad de un átomo para atraer electrones en un enlace covalente.
- Esta propiedad varía a lo largo de la Tabla Periódica y depende de factores como el tamaño del átomo y la carga nuclear efectiva.
- La electronegatividad tiene aplicaciones en la determinación del tipo de enlace, la predicción de la polaridad de las moléculas y la capacidad de oxidación y reducción de los elementos.
Comprender la electronegatividad nos permite entender mejor las interacciones entre átomos y moléculas, y cómo influyen en las propiedades de las sustancias químicas. Es una herramienta valiosa para dominar la química de los elementos y su comportamiento en distintos contextos.
Cómo varía la electronegatividad a lo largo de la Tabla Periódica
La electronegatividad es una propiedad química que describe la capacidad de un átomo para atraer electrones en un enlace covalente. Es importante comprender cómo varía esta propiedad a lo largo de la Tabla Periódica, ya que tiene un impacto significativo en las propiedades y comportamiento de los elementos.
En general, en la Tabla Periódica, la electronegatividad tiende a aumentar de izquierda a derecha y de abajo hacia arriba. Esto se debe a la influencia de dos factores principales: el tamaño del átomo y su carga nuclear efectiva.
A medida que nos desplazamos de izquierda a derecha en un mismo período, el número de protones en el núcleo del átomo aumenta, lo que significa que hay una mayor atracción ejercida sobre los electrones en la última capa. Como resultado, los átomos en los elementos de la derecha de la tabla tienen una mayor electronegatividad porque pueden atraer más fuerza a los electrones compartidos en un enlace covalente.
Por otro lado, al desplazarnos de arriba hacia abajo en un grupo, el tamaño del átomo aumenta debido a la adición de capas electrónicas. Aunque la carga nuclear también aumenta, la distancia entre el núcleo y los electrones de valencia disminuye, lo que debilita la atracción efectiva entre ellos. Como resultado, la electronegatividad disminuye cuando bajamos en un grupo de la Tabla Periódica.
Es importante tener en cuenta que existen algunas excepciones a esta tendencia general. La electronegatividad del hidrógeno y de los elementos de la familia del boro (Grupo 13) es mayor de lo esperado debido a su configuración electrónica particular.
Además, el fluoruro (F) se considera el elemento más electronegativo en la Tabla Periódica, con un valor de electronegatividad estándar de 3.98 en la escala de Pauling. Por otro lado, el francio (Fr) y el cesio (Cs) son los elementos menos electronegativos, con valores de electronegatividad muy bajos.
La importancia de la electronegatividad en la química
La electronegatividad es una propiedad clave para comprender la formación y el comportamiento de los enlaces químicos. Determina la atracción de los átomos por los electrones en un enlace, lo que afecta la polaridad de las moléculas y la naturaleza de las fuerzas intermoleculares.
La diferencia de electronegatividad entre dos átomos enlazados determina el tipo de enlace que se forma. Si la diferencia es pequeña, se forma un enlace covalente no polar, donde los electrones se comparten de manera igualitaria. Sin embargo, cuando hay una gran diferencia de electronegatividad, se forma un enlace covalente polar o iónico, donde los electrones se desplazan hacia al átomo más electronegativo.
Cuáles son los elementos más electronegativos y menos electronegativos
La electronegatividad es una propiedad química fundamental que describe la capacidad de un átomo para atraer electrones hacia sí mismo en una molécula. En otras palabras, es la medida de la atracción que ejerce un átomo sobre los electrones compartidos en un enlace químico. La electronegatividad puede variar significativamente entre diferentes elementos y es uno de los factores clave que determinan la naturaleza y el comportamiento de las sustancias químicas.
En la tabla periódica, la electronegatividad tiende a aumentar de izquierda a derecha a lo largo de un período y disminuir de arriba hacia abajo a lo largo de un grupo. Esto se debe a que a medida que los átomos ganan más protones en su núcleo o tienen mayor radio atómico, aumenta su capacidad de atraer electrones. Como resultado, los elementos en la esquina superior derecha de la tabla periódica son generalmente los más electronegativos, mientras que los elementos en la esquina inferior izquierda son los menos electronegativos.
Algunos de los elementos más electronegativos son el flúor (F), el oxígeno (O), el cloro (Cl) y el nitrógeno (N). Estos elementos poseen una alta afinidad por los electrones y tienden a atraerlos hacia sí mismos de manera muy efectiva. Por otro lado, los elementos menos electronegativos incluyen metales como el cesio (Cs), el francio (Fr) y el litio (Li). Estos metales tienen una menor atracción hacia los electrones y tienden a perderlos más fácilmente.
La electronegatividad de un elemento también puede influir en la polaridad de los enlaces químicos. Cuando la electronegatividad entre dos átomos involucrados en un enlace es similar, se considera un enlace covalente no polar. Sin embargo, si hay una diferencia significativa en electronegatividad, el enlace será polar, lo que resultará en una distribución desigual de carga eléctrica dentro de la molécula.
Factores que afectan la electronegatividad
- Carga nuclear efectiva: cuanto mayor sea la carga nuclear efectiva experimentada por los electrones de valencia de un átomo, mayor será su electronegatividad. La carga nuclear efectiva se ve afectada por el número de protones y la pantalla proporcionada por los electrones internos.
- Tamaño atómico: a medida que aumenta el tamaño del átomo, disminuye la electronegatividad debido a la mayor distancia entre el núcleo y los electrones de valencia. Los electrones están menos influenciados por la atracción del núcleo cuando se encuentran más alejados.
- Estructura de la molécula: la forma y estructura de una molécula pueden afectar la electronegatividad de sus átomos constituyentes. Por ejemplo, los elementos en una molécula con enlaces múltiples tienden a ser más electronegativos que en una molécula con enlaces simples.
La electronegatividad es una propiedad crucial para comprender la química de los elementos. Varía a través de la tabla periódica y depende de factores como la carga nuclear efectiva, el tamaño atómico y la estructura molecular. Al entender la electronegatividad, podemos predecir cómo se forman y comportan las sustancias químicas, lo que es fundamental en varias ramas de la ciencia.
Cómo afecta la electronegatividad a la formación de enlaces químicos
La electronegatividad es una propiedad de los elementos químicos que nos indica su capacidad para atraer electrones en un enlace químico. Esta propiedad juega un papel fundamental en la formación de enlaces y en la estabilidad de las moléculas.
En la tabla periódica, la electronegatividad aumenta de izquierda a derecha y de abajo hacia arriba. Esto significa que los elementos situados en la esquina superior derecha de la tabla periódica son los más electronegativos, mientras que los ubicados en la esquina inferior izquierda son los menos electronegativos.
La diferencia de electronegatividad entre dos átomos determina qué tipo de enlace se formará entre ellos. Si la diferencia de electronegatividad es pequeña, se forma un enlace covalente no polar, donde los electrones se comparten de manera equitativa entre los átomos. En cambio, si la diferencia de electronegatividad es grande, se forma un enlace covalente polar o un enlace iónico.
En los enlaces covalentes polares, el átomo más electronegativo atrae con mayor fuerza los electrones, lo que da lugar a la formación de cargas parciales positivas y negativas en los átomos. Estas diferencias de carga generan una atracción electrostática entre los átomos que mantiene unidos los enlaces. Un ejemplo común de enlace covalente polar lo encontramos en la molécula de agua (H2O).
- El oxígeno, al ser más electronegativo, atrae con mayor fuerza los electrones compartidos.
- Esto genera una distribución desigual de carga en la molécula: el oxígeno adquiere una carga parcial negativa y los átomos de hidrógeno adquieren una carga parcial positiva.
- La atracción electrostática entre las cargas parciales opuestas mantiene unidas las moléculas de agua.
En los enlaces iónicos, se produce una transferencia completa de electrones desde un átomo al otro. Esto ocurre cuando la diferencia de electronegatividad es tan grande que uno de los átomos atrae completamente los electrones de valencia del otro. Como resultado, se forman iones: uno positivo (cationes) y otro negativo (aniones), que se atraen mutuamente debido a la fuerza electrostática entre cargas.
Un ejemplo clásico de enlace iónico es el cloruro de sodio (NaCl).
- El sodio cede un electrón al cloro, que es más electronegativo, generando así un catión sodio Na+ y un anión cloruro Cl-.
- Los iones Na+ y Cl- se atraen mutuamente, formando una estructura cristalina sólida conocida como sal común.
La electronegatividad es una propiedad esencial para comprender cómo se forman los enlaces químicos y cómo interactúan los diferentes elementos en las moléculas. Al conocer la electronegatividad de los elementos, podemos predecir qué tipo de enlace se formará y cómo se comportarán las sustancias químicas en diferentes reacciones.
Cuál es la relación entre la electronegatividad y las propiedades físicas de los elementos
La electronegatividad es una propiedad química que describe la tendencia de un átomo a atraer electrones hacia sí mismo cuando forma un enlace químico con otro átomo. Es una propiedad fundamental para comprender las propiedades físicas de los elementos y cómo interactúan entre sí.
La electronegatividad varía en la tabla periódica de manera gradual y periódica. En general, aumenta de izquierda a derecha en un periodo y disminuye de arriba a abajo en un grupo. Esto se debe a la influencia de diversos factores como el tamaño del átomo, su carga nuclear efectiva y la cantidad de capas de electrones.
Cuando un átomo tiene alta electronegatividad, tiende a atraer con mayor fuerza los electrones compartidos en un enlace químico. Esto implica que el átomo se vuelve más polar o cargado parcialmente negativo, mientras que el átomo con menor electronegatividad se vuelve polar positivo. Estas diferencias de carga te permiten predecir cómo se distribuirán los electrones y cómo interactuarán los elementos entre sí.
La variación de la electronegatividad en la tabla periódica afecta directamente a las propiedades físicas de los elementos. Por ejemplo, los elementos con alta electronegatividad tienden a tener puntos de ebullición y fusión más altos, ya que los enlaces entre átomos son más fuertes debido a la atracción de electrones. Además, estos elementos también suelen ser buenos conductores de electricidad y calor, ya que los electrones se mueven con facilidad a lo largo de la estructura del material.
Por otro lado, los elementos con baja electronegatividad tienden a ser más reactivos y a formar enlaces iónicos. Esto se debe a que tienen una mayor capacidad para desprender electrones y formar iones positivos, o ceder electrones para formar enlaces con otros elementos. Estos elementos suelen tener puntos de ebullición y fusión más bajos, y son malos conductores de electricidad y calor en estado sólido.
La electronegatividad es un concepto crucial en la química, ya que permite comprender cómo los átomos interactúan entre sí y cómo se distribuyen los electrones en un enlace químico. La variación de la electronegatividad en la tabla periódica está relacionada directamente con las propiedades físicas de los elementos, como su punto de fusión, punto de ebullición, conductividad eléctrica y reactividad.
Puede la electronegatividad predecir la polaridad de una molécula
La electronegatividad es una propiedad química que nos permite comprender cómo se distribuyen los electrones en una molécula. Al conocer la electronegatividad de los átomos que forman una conexión química, podemos predecir si esa molécula será polar o no polar.
Para entender mejor este concepto, debemos remontarnos a la definición de electronegatividad. La electronegatividad es la capacidad que tiene un átomo para atraer hacia sí los electrones compartidos en una unión química. Esta capacidad está influenciada por varios factores como el tamaño del átomo, su carga nuclear efectiva y la distancia entre los electrones de valencia y el núcleo.
En la Tabla Periódica, podemos observar que la electronegatividad aumenta a medida que nos desplazamos de izquierda a derecha en un periodo y de abajo hacia arriba en un grupo. Esto significa que los elementos en la parte superior derecha de la Tabla Periódica, como el flúor y el oxígeno, son los más electronegativos, mientras que los elementos en la parte inferior izquierda, como los metales alcalinos, son los menos electronegativos.
Ahora bien, ¿cómo podemos usar la electronegatividad para predecir la polaridad de una molécula? La clave radica en la diferencia de electronegatividad entre los átomos que componen la molécula. Si esta diferencia es alta, se crea una atracción asimétrica de los electrones compartidos, generando polos positivos y negativos en la molécula. Esto da lugar a una molécula polar.
Por ejemplo, consideremos la molécula de agua (H2O). El oxígeno es más electronegativo que el hidrógeno, lo que significa que los electrones compartidos entre el oxígeno y el hidrógeno se atraen con mayor fuerza hacia el oxígeno. Como resultado, el oxígeno adquiere una carga parcialmente negativa, mientras que los átomos de hidrógeno adquieren cargas parciales positivas. Esta distribución asimétrica de cargas hace que la molécula de agua sea polar.
Por otro lado, si la diferencia de electronegatividad entre los átomos de una molécula es pequeña o inexistente, los electrones compartidos se distribuyen de manera más uniforme, generando una molécula no polar. Un ejemplo de esto es la molécula de dióxido de carbono (CO2), donde los átomos de carbono y oxígeno tienen la misma electronegatividad, resultando en una distribución simétrica de las cargas.
La electronegatividad es una propiedad fundamental para predecir la polaridad de las moléculas. Nos permite comprender cómo los átomos interactúan entre sí y cómo se distribuyen los electrones en una unión química. Recordemos que una diferencia alta de electronegatividad genera una molécula polar, mientras que una diferencia baja o nula produce una molécula no polar. Esta información es invaluable en la química, ya que nos ayuda a entender cómo las moléculas interactúan entre sí en diversas reacciones y fenómenos.
Cuál es el impacto de la electronegatividad en la solubilidad y reactividad de los compuestos químicos
La electronegatividad es una propiedad química fundamental que nos permite comprender cómo los elementos interactúan entre sí y forman enlaces. Es la capacidad de un átomo para atraer hacia sí los electrones compartidos en un enlace químico. En la Tabla Periódica, la electronegatividad aumenta de izquierda a derecha y de abajo hacia arriba.
La variación de la electronegatividad en la Tabla Periódica tiene un impacto significativo en la solubilidad y reactividad de los compuestos químicos. Los átomos con alta electronegatividad tienen una mayor atracción por los electrones, lo que significa que tienden a atraer electrones adicionales y son más propensos a formar enlaces iónicos o covalentes polares.
Solubilidad de los compuestos según su electronegatividad
La solubilidad de un compuesto depende de la interacción de sus moléculas o iones en una solución. Los compuestos con enlaces iónicos o covalentes polares, debido a la diferencia en la electronegatividad de los átomos, tienden a ser solubles en disolventes polares como el agua.
Los elementos altamente electronegativos, como el oxígeno (O) y el flúor (F), forman enlaces covalentes polares fuertes y pueden participar en interacciones dipolo-dipolo con las moléculas de agua. Esto facilita la solubilidad de los compuestos que contienen estos elementos en agua y otros disolventes polares.
Por otro lado, los compuestos con enlaces covalentes no polares tienen una electronegatividad similar entre los átomos que participan en el enlace. Estos compuestos tienden a ser insolubles en agua y otros disolventes polares debido a la falta de atracción significativa entre las moléculas del compuesto y las moléculas de disolvente polar.
Reactividad de los compuestos según su electronegatividad
La electronegatividad también influye en la reactividad química de los compuestos. En general, los elementos altamente electronegativos son más propensos a aceptar electrones y formar iones negativos durante las reacciones químicas.
Por ejemplo, el flúor (F) es el elemento más electronegativo en la Tabla Periódica y, por lo tanto, tiene una gran afinidad por los electrones. Tiende a ganar electrones para completar su octeto y formar iones flúor negativos (F-). Esto hace que el flúor sea muy reactivo y participe en una variedad de reacciones químicas.
Además, la diferencia de electronegatividad entre dos elementos en un enlace covalente también puede influir en la reactividad de los compuestos. La electronegatividad juega un papel importante en la polaridad de los enlaces covalentes, lo que a su vez afecta la distribución de carga en las moléculas.
La electronegatividad tiene un impacto significativo en la solubilidad y reactividad de los compuestos químicos. La variación de la electronegatividad en la Tabla Periódica determina las propiedades de los elementos y su capacidad para formar enlaces. Comprender la electronegatividad nos ayuda a comprender mejor cómo interactúan los elementos entre sí y qué tipo de compuestos se pueden formar.
Cómo se utiliza la electronegatividad para determinar la geometría molecular
La electronegatividad es una propiedad química fundamental que juega un papel crucial en la determinación de la geometría molecular. Esta propiedad está relacionada con la capacidad de un átomo para atraer electrones hacia sí mismo cuando forma enlaces químicos con otros átomos. En otras palabras, nos permite entender cómo se distribuyen los electrones alrededor de un átomo central y cómo esto afecta la forma en la que las moléculas se organizan en el espacio.
Para comprender mejor cómo se utiliza la electronegatividad en la determinación de la geometría molecular, es importante recordar algunos conceptos básicos de la teoría de enlace químico. En primer lugar, debemos tener en cuenta que los átomos interactúan entre sí para alcanzar una configuración electrónica más estable.
La electronegatividad se mide en una escala relativa, siendo el flúor el elemento más electronegativo con un valor de 4.0. Cuanto mayor sea la electronegatividad de un elemento, más fuerte será su atracción por los electrones compartidos en un enlace químico. Por lo tanto, cuando dos átomos con diferentes electronegatividades se unen, se formará un enlace polar, en el cual los electrones se pasarán de un átomo al otro con mayor facilidad.
Es precisamente esta diferencia en electronegatividad la que nos permite determinar la geometría molecular de una molécula. Dependiendo de la disposición espacial de los átomos y del carácter polar o no polar de los enlaces, podemos predecir si una molécula será lineal, trigonal plana, tetraédrica u otra geometría molecular.
Por ejemplo, consideremos la molécula de agua (H2O). El oxígeno es más electronegativo que el hidrógeno, por lo que los enlaces químicos entre ellos son polares. La geometría molecular de la molécula de agua es conocida como bent o angular, y se debe a que los dos pares de electrones no enlazantes alrededor del átomo central provocan una repulsión que empuja los átomos de hidrógeno hacia un lado. Esto resulta en una estructura asimétrica con un ángulo de enlace de aproximadamente 104.5 grados.
Otro ejemplo sería el dióxido de carbono (CO2). En este caso, tanto el oxígeno como el carbono son altamente electronegativos, pero tienen una electronegatividad similar. Como resultado, los enlaces CO en la molécula de dióxido de carbono son no polares. La geométria molecular de esta molécula es lineal, ya que no hay electrones no enlazantes presentes alrededor del átomo central para alterar su forma.
La electronegatividad es una herramienta valiosa para determinar la geometría molecular de una molécula. A través de las diferencias de electronegatividad entre los átomos, podemos predecir si los enlaces formados serán polares o no polares, y cómo estos enlaces influirán en la forma tridimensional de la molécula. Comprender la geometría molecular es esencial para entender las propiedades y reactividad de las sustancias químicas, y la electronegatividad nos brinda un valioso punto de partida.
Hay alguna excepción a la tendencia general de electronegatividad en la Tabla Periódica
La electronegatividad es una propiedad química fundamental que nos permite entender cómo los átomos interactúan entre sí en una molécula. Generalmente, la electronegatividad aumenta de izquierda a derecha en un período y disminuye de arriba hacia abajo en un grupo de la Tabla Periódica. Sin embargo, existen algunas excepciones a esta tendencia general que vale la pena explorar.
Familia de los gases nobles
Los gases nobles son conocidos por ser altamente estables y poco reactivos debido a su configuración electrónica completa en la capa de valencia. Al tener una alta electronegatividad, estos elementos no tienden a ganar ni perder electrones, ya que tienen una afinidad electrónica muy baja. Su electronegatividad prácticamente no varía a lo largo de la tabla, lo que los convierte en una excepción a la tendencia general.
Metales alcalinos
Los metales alcalinos se encuentran en el grupo 1 de la Tabla Periódica, y son conocidos por tener baja electronegatividad debido a su gran tamaño atómico y baja carga nuclear efectiva. Estos elementos tienden a perder fácilmente el electrón de valencia para obtener una configuración estable, lo que los hace altamente electropositivos. Su electronegatividad aumenta ligeramente a medida que se desciende en el grupo, pero siguen manteniendo una tendencia generalmente baja en comparación con otros elementos de la tabla.
Aluminio
Aunque el aluminio se encuentra en el grupo 13 de la Tabla Periódica, su electronegatividad es inusualmente alta en comparación con otros elementos en el mismo grupo. Esta alta electronegatividad se debe a su configuración electrónica y a su estructura de enlace. A pesar de estar en una columna con elementos metálicos, el aluminio muestra algunos comportamientos que son más consistentes con los no metales en términos de electronegatividad.
Lantánidos
Los lantánidos son un grupo de elementos químicos que se encuentran en la fila inferior de la tabla periódica y son conocidos por su extrema rareza y propiedades magnéticas. Estos elementos tienen una alta electronegatividad debido a su capacidad para atraer electrones adicionales hacia sus capas de valencia. Aunque se encuentran en la serie de tierras raras, su electronegatividad varía más significativamente que otros grupos debido a la presencia de diferentes electrones de valencia en cada elemento del grupo.
- Aunque existe una tendencia general en la Tabla Periódica en cuanto a la electronegatividad, hay algunas excepciones notables que desafían esta tendencia. Los gases nobles y los metales alcalinos son algunos ejemplos claros de elementos que no siguen la tendencia general debido a su configuración electrónica y tamaño atómico. El aluminio también destaca como un metal que muestra una electronegatividad inusualmente alta en comparación con otros metales en su grupo. Además, los lantánidos demuestran una variación significativa en la electronegatividad debido a las diferencias en su configuración electrónica.
- La comprensión de estas excepciones es crucial para dominar la química de los elementos y establecer relaciones entre ellos. La electronegatividad nos permite predecir cómo se forman los enlaces químicos y cómo estos enlaces afectan las propiedades físicas y químicas de las sustancias. Al conocer estas excepciones, podemos construir modelos más precisos y completos de la química de los elementos.
Cómo podemos utilizar la electronegatividad para predecir el comportamiento químico de los elementos en una reacción
La electronegatividad es una propiedad química que nos permite predecir el comportamiento de los elementos en una reacción. Nos ayuda a entender cómo los átomos interactúan entre sí y a qué grado un átomo tiene la capacidad de atraer electrones en un enlace químico.
En la Tabla Periódica, la electronegatividad generalmente aumenta de izquierda a derecha y de abajo hacia arriba. Esto significa que los átomos en el lado izquierdo de la tabla, como los metales alcalinos, tienen una electronegatividad baja, mientras que los átomos en el lado derecho, como los halógenos, tienen una alta electronegatividad. Además, los elementos en la parte superior de la tabla también suelen tener una alta electronegatividad.
Algunas excepciones notables incluyen el hidrógeno y el carbono. A pesar de estar ubicados en el lado derecho de la tabla, el hidrógeno tiene una electronegatividad baja debido a su único electrón y tamaño pequeño. Por otro lado, el carbono tiene una electronegatividad relativamente alta debido a su capacidad para formar enlaces con otros átomos.
¿Cómo podemos utilizar esta información para predecir el comportamiento químico?
La electronegatividad nos permite determinar si un enlace químico será covalente o iónico. Un enlace covalente ocurre cuando dos átomos comparten electrones de manera equitativa, lo que resulta en una molécula estable. En contraste, un enlace iónico ocurre cuando un átomo atrae electrones de otro átomo, creando una separación de cargas y formando un compuesto iónico.
Por ejemplo, si tenemos dos átomos con electronegatividades similares, es probable que formen un enlace covalente, ya que ninguno tiene una gran capacidad para atraer o ceder electrones. Sin embargo, si un átomo tiene una alta electronegatividad en comparación con el otro, es probable que forme un enlace iónico, ya que la atracción del átomo más electronegativo hacia los electrones será mayor.
Además, la electronegatividad también nos permite predecir la polaridad de una molécula. Cuando dos átomos con electronegatividades diferentes forman un enlace covalente, los electrones no se comparten equitativamente, lo cual da lugar a una distribución desigual de cargas. Esto resulta en una molécula polar, donde un extremo de la molécula tiene una carga positiva parcial y el otro extremo tiene una carga negativa parcial.
La electronegatividad es una propiedad útil que nos ayuda a entender cómo se comportan los elementos en una reacción química. Nos permite predecir el tipo de enlace que se formará entre dos átomos y determinar la polaridad de una molécula. Al comprender y utilizar la electronegatividad, podemos dominar la química de los elementos y tener un mayor control sobre las reacciones químicas.
Preguntas frecuentes (FAQ)
1. ¿Qué es la electronegatividad?
La electronegatividad es una propiedad de los átomos que indica su capacidad de atraer electrones en un enlace químico.
2. ¿Cómo varía la electronegatividad en la Tabla Periódica?
La electronegatividad aumenta de izquierda a derecha y disminuye de arriba hacia abajo en la Tabla Periódica.
3. ¿Cuáles son los elementos más electronegativos?
Los elementos más electronegativos son el flúor, el oxígeno, el nitrógeno y el cloro.
4. ¿Cuáles son los elementos menos electronegativos?
Los elementos menos electronegativos son los metales alcalinos y alcalinotérreos, como el sodio y el calcio.
5. ¿Cómo influye la electronegatividad en la formación de enlaces químicos?
La diferencia de electronegatividad entre dos átomos determina el tipo de enlace que se formará: covalente polar, covalente no polar o iónico.

Deja una respuesta